COMBUSTIÓN
La combustión es un cambio químico porque las sustancias iniciales son diferentes a las finales.
Este cambio o reacción química se puede representar mediante una ecuación química igualada.
Considerando que el supergás que usamos en las cocinas domésticas es una mezcla de propano y butano podríamos representar la combustión del propano de la siguiente manera:
C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + 4 H2O (I)
Aquí podemos ver que los reactivos se ubican a la izquierda de la flecha (propano y dioxígeno) y los productos a la derecha de la flecha (dióxido de carbono y agua).
Los coeficientes estequiométricos se utilizan para representar corpuscularmente la Ley de conservación de la masa.
A nivel corpuscular podemos representar esta ecuación química de la siguiente manera:
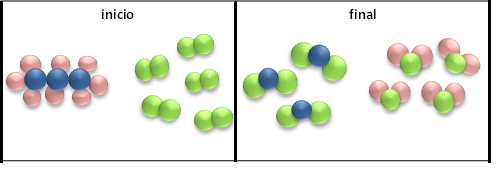 En esta representación se refleja claramente la conservación del número de átomos al inicio y al final, observándose las distintas uniones para formar sustancias diferentes.
En esta representación se refleja claramente la conservación del número de átomos al inicio y al final, observándose las distintas uniones para formar sustancias diferentes.
Es una reacción química exotérmica porque libera energía en forma de luz y calor. Sus elementos básicos para que se produzca son: combustible, comburente y temperatura de ignición.
Es una representación simbólica de una reacción en la cual aparecen los reactivos y los productos representados mediante sus fórmulas químicas.
Los estados de agregación de las sustancias se indican a la derecha de cada sustancia entre paréntesis con letra minúscula.
Son números enteros que se colocan adelante de las fórmulas en una ecuación química y multiplican la cantidad de átomos representados en cada fórmula que antecede.
Se rompen los enlaces químicos de las sustancias iniciales y forman nuevos enlaces que originan las sustancias finales